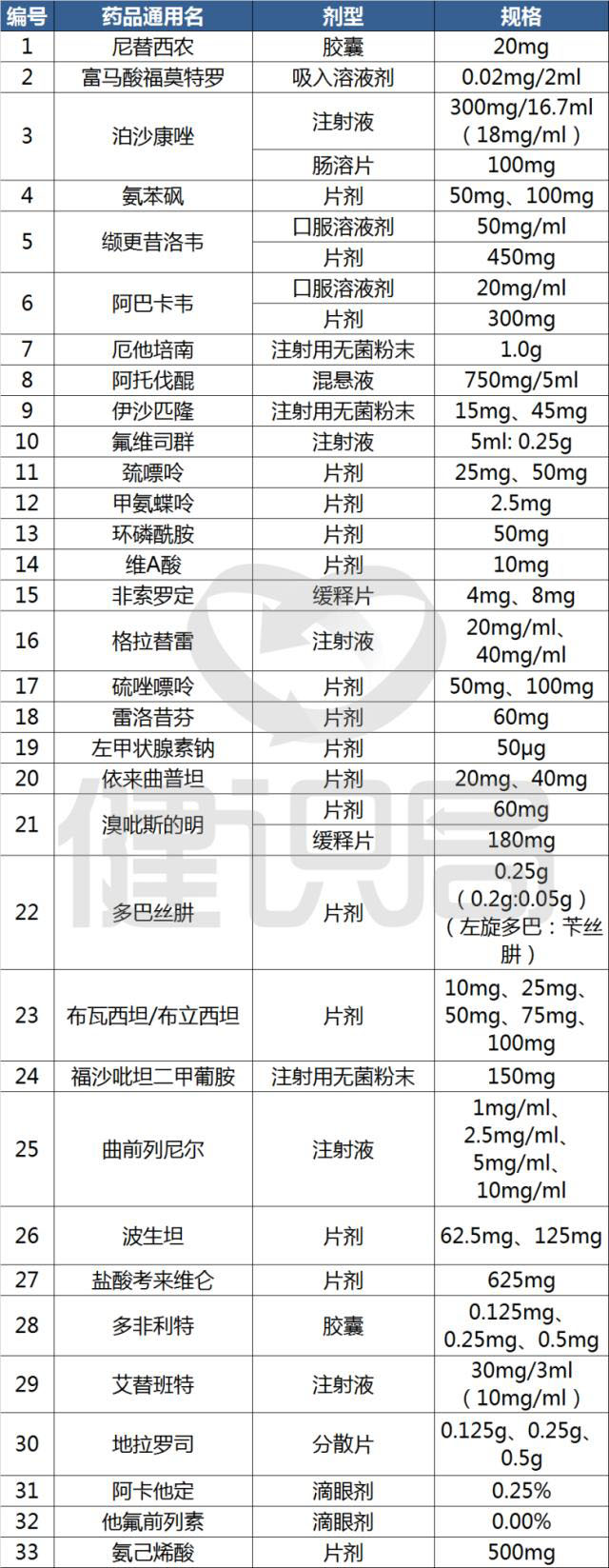
10月9日,国家卫生健康委官网发布通知,公示第一批鼓励仿制的33个药品,并要求各相关部门要按照有关规定,在临床试验、关键共性技术研究、优先审评审批等方面予以支持。
根据通知,上述目录为国家卫生健康委联合科技部、工业和信息化部、国家药监局、国家知识产权局等部门组织专家对国内专利到期和专利即将到期尚没有提出注册申请、临床供应短缺(竞争不充分)以及企业主动申报的药品进行遴选论证后制定。
可以看到,目录中很多药品都是临床急需的救急救命药,有一些还没有在国内上市。
如尼替西农,用于治疗遗传性酪氨酸血症I型。这种罕见病在遗传性酪氨酸血症中也是最凶险的分型,发病率约为1/10万,目前仅此一种药物可以治疗。该药已分别于2015年6月和2016年12月获批在欧盟和美国获批上市,但是尚未进入我国市场。
而包括儿童白血病用药巯嘌呤等,则因为价格过于低廉面临着停产的风险,治疗麻风病的氨苯砜问题尤为突出。
健识局查询国家药监局数据发现,昆药集团、广州白云山光华制药、上海信谊天平药业、广州市花城制药厂、重庆华邦凯胜制药股份有限公司等多家企业握有该产品的批文,但是由于价格低廉,国内企业已经不再生产其原料和制剂,目前临床主要使用慈善捐赠的国外药品。2017年还曾被列入卫健委等多部门列出的139个短缺药目录。
此外,还有一些原研药已在国内上市,且市场前景较好的产品。如缬更昔洛韦,用于治疗巨细胞病毒(CMV)性视网膜炎(这是一种艾滋病患者晚期最常见的眼部机会性感染),由罗氏生产,2006年在我国上市后450mg,60片规格的售价约为16500元。此前河北仁合益康和重庆圣华曦等药企已经在研发其仿制药。
事实上,国家有关部门鼓励企业研发仿制药早已有之。2018年,国家药监局药品审评中心就曾经分两次对国内化合物专利到期、终止、无效且尚无仿制申请的国外已上市药品进行筛选,初步筛选出硫酸阿扎那韦等16个具有明确临床价值的药品名单。其中不乏全球销售500强品种。
从4+7带量采购,医保目录动态调整等新政看,质量和疗效与原研药一致的仿制药未来将成为我国医药市场主导,特别是对一些临床急需而原研药品价格居高不下的药品,急待国内仿制药对其进行替代。因此,业界分析,针对此次五部门公示的33个品种,如果企业能够及时研发成功,无疑将迎来巨大利好。
附录:
第一批鼓励仿制药品目录
↓↓