
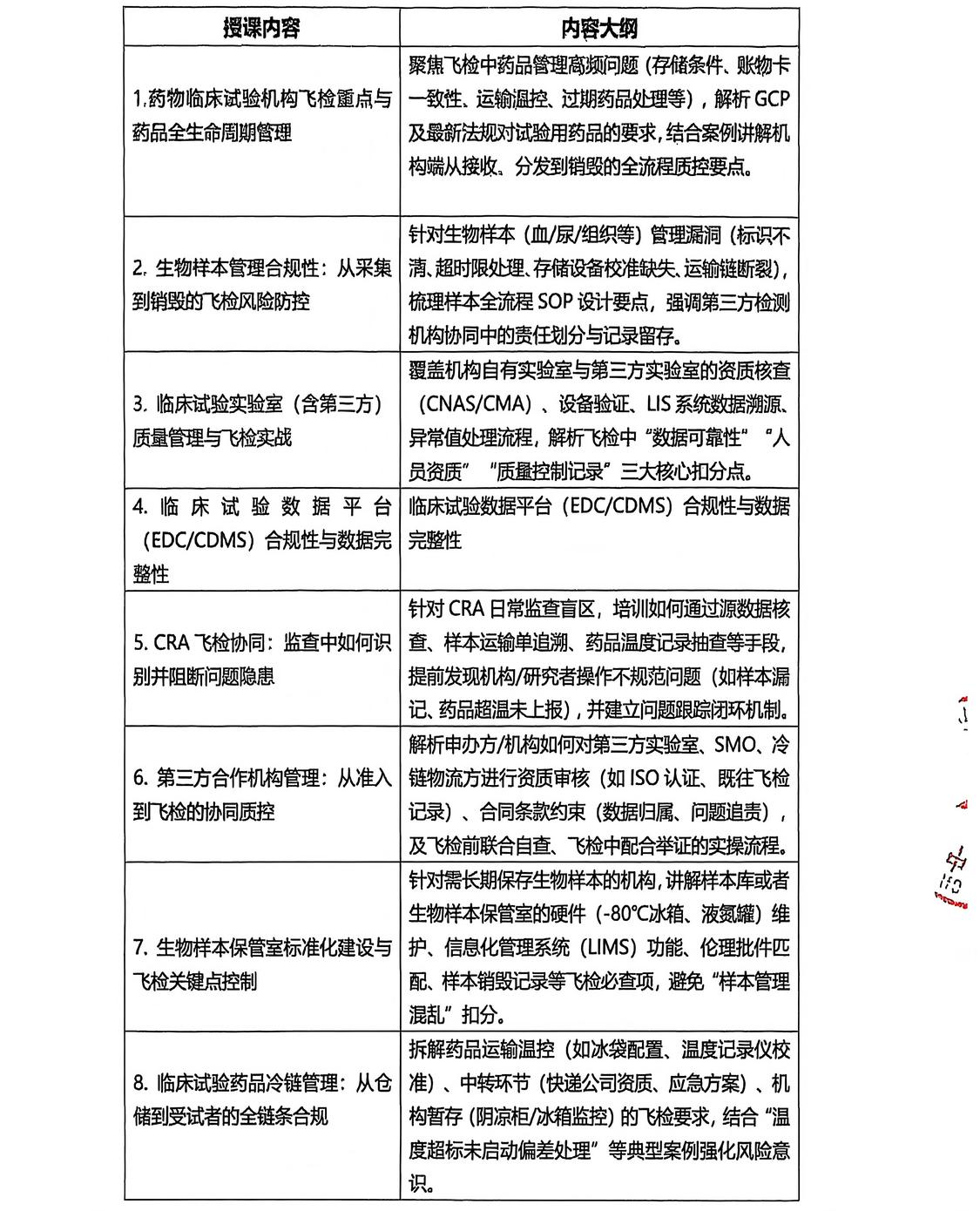
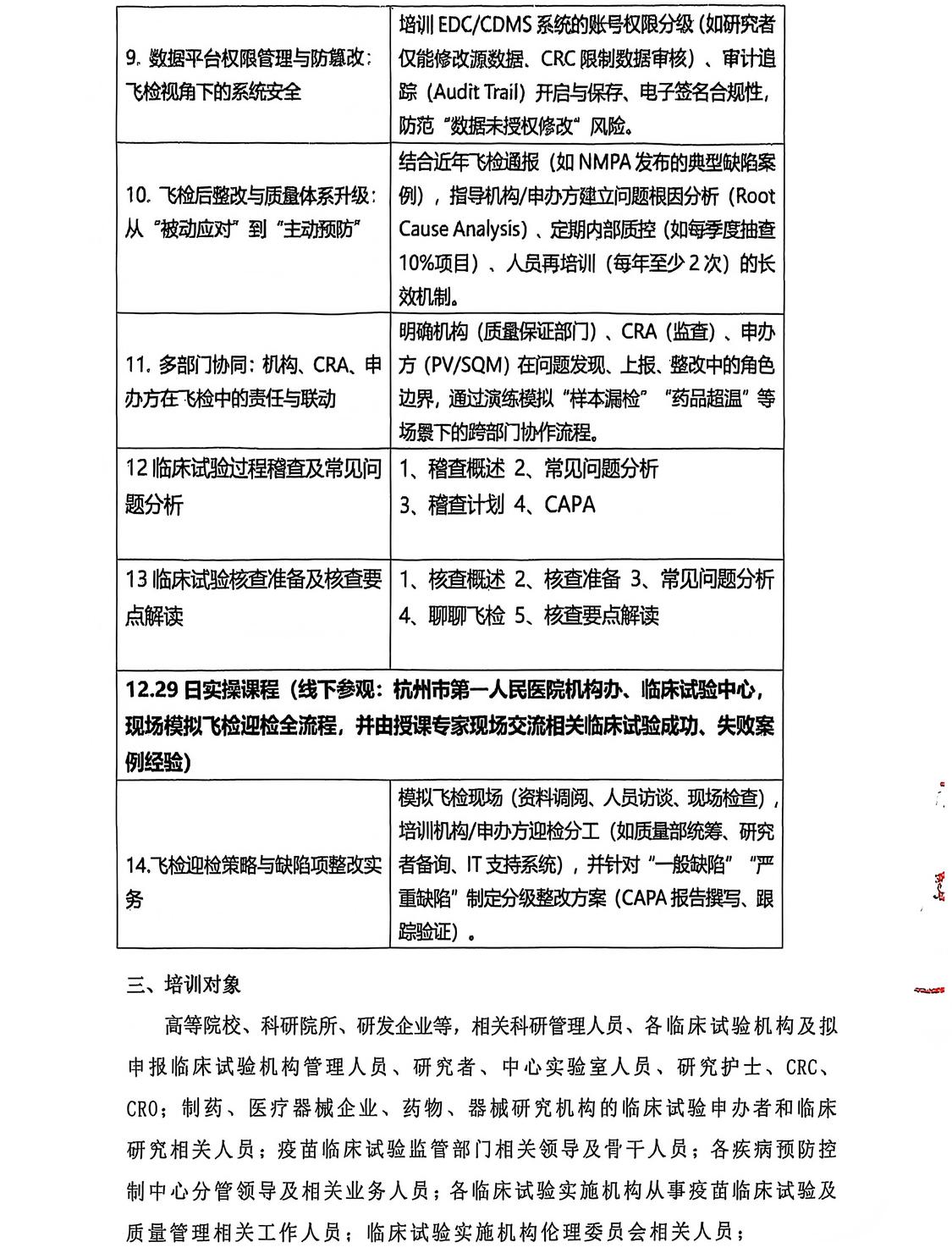

为了提高医疗机构伦理审查及GCP人员的能力提升,可根据机构实际情况做针对性培训,具体可咨询会议负责人李老师13601364696。 主办单位简介:中国民族卫生协会是经国务院批准、民政部登记、注册、国家卫生健康委员会主管的国家一级协会,成立于2005年5月18日。 2025年医药全链条(申办方/机构/实验室)实操稽查、核查与数据合规专题培训班 ---2025年12月27日-28日 1、授课内容以机构工作问题为核心:申办方/机构/实验室迎检分工(如质量部统筹、研究者备询、IT支持系统),并针对“一般缺陷”“严重缺陷”制定分级整改方案(CAPA报告撰写、跟踪验证); 2、聚焦飞检要点,直击临床试验机构、申办方、机构、实验室问题核心,以理论课程为基准,促使各(申办方/机构/实验室)更加规范性、合理性; 请各单位接此通知后积极转发并组织相关人员届时参加培训,参加本次学习的学员请将报名回执填写后发到会务负责人李老师微信(13601364696);具体会议信息通知在会议开始前3天发给报名学员; 线上:300元/位 线上:青华医学学习平台 培训内容 12月27日上午 9:00-11:00--(程金莲 首都医科大学附属北京中医医院GCP办公室主任;国家药监局临床试验现场核查、会审专家) ◈飞检后整改与质量体系升级:从“被动应对”到“主动预防” 学习内容:结合近年飞检通报(如NMPA发布的典型缺陷案例),指导机构/申办方建立问题根因分析(Root Cause Analysis)、定期内部质控(如每季度抽查10%项目)、人员再培训(每年至少2次)的长效机制。 ◈多部门协同:机构、CRA、申办方在飞检中的责任与联动 11:00-12:00--(王莹 GCP国家级检查员;杭州市第一人民医院院长助理;GCP机构办主任;) ◈药物临床试验机构飞检重点与药品全生命周期管理 12月27日下午 14:00-16:00--(席明名 南京市妇幼保健院临床试验机构办公室主任;江苏省药品监督管理局药品、医疗器械检查员) ◈生物样本管理合规性:从采集到销毁的飞检风险防控 ◈临床试验药品冷链管理:从仓储到受试者的全链条合规 16:00-18:00--(申屠建中 国家新药核查/审评专家) ◈第三方合作机构管理:从准入到飞检的协同质控 ◈临床试验实验室(含第三方)质量管理与飞检实战 12月28日上午 9:00-11:00--(乔阳 医学硕士,南京西格玛医学技术股份有限公司临床总监) ◈CRA飞检协同:监查中如何识别并阻断问题隐患 ◈数据平台权限管理与防篡改:飞检视角下的系统安全 11:00-12:00--(李红英 苏州大学附属第一医院科技处及伦理委员会办公室副研究员) ◈药物临床试验核查过程中涉及的伦理问题 学习内容: 一.知识温习及行业要求 1.核查的目的2.新政及药物临床试验基本要求 二.药临床试验中的风险 1.临床安全2.伦理风险3.数据质控 三.药核查案例借鉴 12月28日下午 14:00-15:00--(吴懿 西湖大学医学院附属杭州市第一人民医院;临床研究部 副主任/副主任医师;国家药监局核查中心现场核查专家) ◈临床试验数据平台(EDC/CDMS)合规性与数据完整性 15:00-17:00--(王丽娜 某global biotech公司任临床质量高级总监) ◈临床试验过程稽查及常见问题分析 1、稽查概述 2、常见问题分析 3、稽查计划 4、CAPA ◈临床试验核查准备及核查要点解读 1、核查概述 2、核查准备 3、常见问题分析 4、聊聊飞检 5、核查要点解读 (排名不分先后,按授课顺序) 程金莲 主任医师,首都医科大学附属北京中医医院GCP办公室主任、HRPP办公室主任,负责医院药物器械临床试验管理及医院HRPP 体系建设和认证。国家药监局临床试验现场核查专家、会审专家,国家中药品种保护审评专家,世中联中医药研究伦理审查体系认证(CAP 认证)审核员,中华中医药协会标准化委员会评审专家,科技部评审专家。中国食品药品企业质量安全促进会临床研究管理专委会第一届委员会副主任委员,中关村玖泰药物临床试验技术创新联盟伦理审查研究评价专业委员会第一届副主任委员,中国药学会第一届药物临床试验伦理学研究专业委员会委员,北京医学伦理学会医学伦理审查分会副主任委员、秘书长,中华中医药学会中药临床药理分会常务委员,世中联临床疗效评价专委会常务理事。牵头发布团体标准 3 项。 王 莹 杭州市第一人民医院院长助理GCP机构办主任 杭州市卫生健康创新与转化中心主任 浙江省自然科学”杰出青年基金”获得者 浙江省万人计划青年拔尖人才 浙江省卫生创新人才 浙江省151人才工程 第一完成人获得浙江省科学技术进步奖二等奖2项 主要完成人参与获得浙江省科学技术进步奖2项 第一完成人获得浙江省医药卫生科技进步奖一等奖 第二完成人获得浙江省医药卫生科技进步奖二等奖2项、浙江省自然科学学术奖二等奖等多项 主持国家级课题2项、省杰青、省尖兵领雁项目、省部级课题7项 第一作者或通讯作者发表SCI论文70篇,其中二区及以上20篇 担任多个SCI杂志Section Editor或审稿专家 GCP国家级检查员 席明名 主任中药师,执业药师; 南京市妇幼保健院临床试验机构办公室主任; 中国药科大学硕士研究生导师; 江苏省药品监督管理局药品检查员; 江苏省药品监督管理局医疗器械检查员; 中华中医药学会中药临床药理分会第四届委员; 中华中医药学会中药炮制分会委员; 中华中医药学会中医康复技术传承创新平台常务委员 中国民族医药学会方药量效研究分会常务理事; 中国中医药信息学会中医临床药学分会第二届常务理事; 中国未来研究会中医药一体化发展分会专家委员会常务委员; 世界中医药学会联合会亚健康专业委员会理事; 江苏省中医药学会新药研究开发专业委员会委员;江苏省药学会药物临床评价研究专业委员会委员;南京中医药学会中药临床与中药分析专业委员会委员; 南京药学会临床试验专业委员会委员; 南京市药品质量安全风险评估专家组成员; 南京市科技局临床试验专家库成员; 申屠建中 浙江大学药学本科、药理学硕士、内科学(传染病学)博士学位学历,浙大博士生导师,浙大一院主任药师,国家新药核查/审评专家。长年从事新药I期研究,作为主要研究者承接1类创新药80余个,主持PK/BE 全流程研究300余项。前浙大一院机构副主任,前医院伦理委员会委员,浙一早期临床研究主要创建者,管理国内外各期临床试验1500余项。主要研究方向临床药(毒)理学、临床药物治疗学,擅长创新药成药性分析、个体化精准治疗、治疗药物监测、药物不良反应分析处理。累积发表国内外文章200余篇。主持国家重大新药创制课题多项。PK/PD研究成果列入多个药品说明书。 乔 阳 担任江淮暨安徽 GCP专科联盟委员、神经医学创新与转化联盟核心成员、南京医科大学校外教师,在临床试验领域拥有15+多年工作经验,主导和参与临床试验方案设计,临床试验项目管理300多项;参与EDC和CTMS系统的建设和改进,并取得多项软件著作权;主导过多个国产首创创新医疗器械的临床研究并转化上市,涉及细分领域广泛,在骨科、整形外科、眼科、肾内科、口腔科、麻醉科、病理科、护理部等方面具有丰富的临床试验实战经验。 多次为研究中心及大学、医疗器械企业提供医疗器械临床试验相关培训。 李红英 兼国家人口与文化促进会医院人文管理与人才培训专委会常委,中国自然辩证法研究会生命伦理学专业委员会理事,苏州市中医医院生殖医学伦理委员会副主任委员,深圳市创新中心深圳华大研究院科技伦理审查委员会委员,国家基因库伦理委员会委员,多家机构医学伦理委员会委员或独立专家顾问,《中国伦理学杂志》审稿专家/学术委员会委员。曾任中国医学伦理学-生物医学研究创新发展伦理建设委员会副主任委员,中国老年保健协会药物临床研究与评价专业委员会常务理事。 研究方向: 机构伦理委员会建设及运作,临床及研究伦理、政策伦理,卫生管理。 吴 懿 国家药监局核查中心现场核查专家 浙江省药品化妆品审评中心药品检查专家 中国老年保健医学研究会检验医学分会委员 浙江省发明协会血液病专业委员会秘书长 浙江省数理医学学会数字化临床研究专业委员会委员 浙江省转化学会临床试验分会委员 浙江省抗癌协会肿瘤临床研究专委会青年委员 浙江省中西医结合学会临床研究与转化医学专业委员会青年委员 研究方向为:血液病免疫治疗,主持浙江省自然科学基金1项,浙江省科技计划项目1项。以通讯作者(含共同通讯)或第一作者发表SCI收录论文8余篇。 王丽娜 某global biotech公司任临床质量高级总监;专注创新药研发领域20余年,曾长期在MNC和国际CRO工作,在眼科、肿瘤、心血管等领域经验丰富,具有NMPA、PMDA、EMA、TFDA的核查经验。 学员需全程参与所有课程的学习,经考试合格者3日内将获得由中国民族卫生协会电子证书(带章),如需纸质版证书将在7-10日邮寄,本证书编号为唯一编码,可在中国民族卫生协会医院创新管理工作委员会官网下载获取! 证书名称:2025年医药全链条(申办方/机构/实验室)实操稽查、核查与数据合规专题培训班 青华医苑 添加李主任领取会议课件 李主任:13601364696 长按识别二维码领取课件 全心服务 本期编辑:医院创新会
